こんにちは!ばっしーです!(^^)/
2年生の化学分野も今回で最後です\(^o^)/
前回の化学反応式はできるようになったでしょうか?
今回の内容は、前回の化学反応式をもとに
質量について深く考えていくところです(^^)
一緒に載せている学習プリントのKYD!(これさえやっときゃー大丈夫!)プリントも、ぜひ取り組んでみてくださいね(^^♪
質量保存の法則
質量保存の法則とは
化学反応の前後で質量は変わらないという法則です。
例えば3gのマグネシウムと、2gの酸素を反応させると
5gの酸化マグネシウムができる
ということです(^^)/
では、実際にそうなるのか
塩酸と炭酸水素ナトリウムを使って実験してみましょう(^^)/
うすい塩酸と炭酸水素ナトリウムの化合
実際に実験してみましょう\(^o^)/
容器の中に、小さい容器を入れます。
容器の中には炭酸水素ナトリウムを入れます。
小さい容器の中にはうすい塩酸を入れます。
以下には写真も載せていますが、見づらいところもあったので
図でも載せときます(^^;)
こんなイメージ!
写真のように、ふたをしっかり閉め、質量をはかります(^^)

59.7gですね!
次に、この容器を傾け、小さい容器に入った塩酸をこぼします!

こぼれると、炭酸水素ナトリウムと混ざり、ブクブクと気体が発生し始めます
反応し終わった容器は、さわった感じパンパンです( ゚Д゚)
再び質量をはかってみると…

やっぱり59.7ggですねΣ(・□・;)
このように、化学反応の前後では、質量は変わらないのです(^^)/
ちなみにふたを開けてみると、『プシュッ』と音がします。
気体が逃げていったんですね(^^)
パンパンだった容器は元に戻り、
質量をはかると…

はい!軽くなっています(^^)
気体が逃げた分、0.2g軽くなりました
空気にも結構な質量があるんですね~(*_*)
ちょこっと余談
余談というか補足です(^^)/
この実験では、気体が発生しますが
何という気体が発生したか分かりますか(・・?
炭酸水素ナトリウムと塩酸が混ざっています!
NaHCO₃とHClの反応ですよ(^^)/
化学反応式を作ってみてください!
NaHCO₃ + HClですよね?
何が出来そうですか??
では、正解です!
この化学反応を化学反応式を作って書くと
NaHCO₃ + HCl → NaCl + H₂O + CO₂
となり、できるのは
塩化ナトリウムと水と二酸化炭素
ということが分かりますね!(^^)!
先ほどの気体は、二酸化炭素だったのです
そして反応後の液体は、食塩水だったのです(^^)/
銅粉を加熱する実験
この実験では、銅を加熱し、酸素と化合させます。
加熱することで、銅 + 酸素 → 酸化銅
2Cu + O₂ → 2CuOの反応を起こすわけです(^^)
始めの銅粉の質量をはかります。

できた酸化銅の質量をはかります。
と、このような感じで、銅粉の質量を0.2g、0.4g、0.6g、0.8g、1.0g、1.2gと変えて
できた酸化銅の質量をはかります!
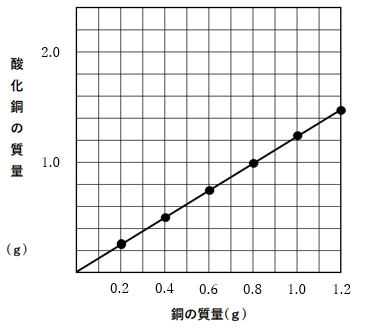
結果はこのようなグラフになりました\(^o^)/
ただ、この実験、
本当はこんなにうまくいきません(^^;)
理由はいくつかあるのですが
銅が全て反応しきっていないということが大きいです(;^_^A
銅粉の量が増えれば増えるほど、内部まで酸素と化合しきらずに
酸化銅の質量が増えません。
人為的なミスなどもよくあり、この実験が完璧な値になることは、あんまりありません(;’∀’)
まあ、実験結果は誤差もあるものとして
理想の結果は先ほどの通り

こうなります(^^)/
この結果からわかることは
銅が0.8gのとき、酸化銅は1.0gできる
ということ!
では、酸素が何g化合したか分かりますか?
正解は0.2gです(^^)
銅が0.8gで、酸素が0.2gなので、できる酸化銅が1.0gなのです(^^)/
比にすると、
銅:酸素:酸化銅は、4:1:5
となりますね(^^)
この質量比は
どこでやっても、いつやっても必ず4:1:5になります!
化合する質量の比は、決まっているのです。
マグネシウムから酸化マグネシウムをつくる
次は、銅の代わりにマグネシウムでやってみましょう!
マグネシウムから、酸化マグネシウムをつくる実験を行うと、結果は以下のようになります。
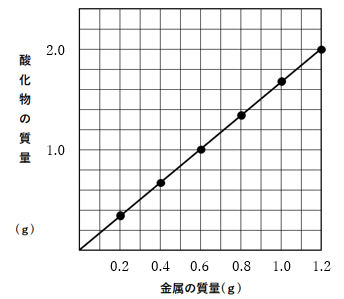
このグラフを読み取りましょう(^^)/
マグネシウムが1.2gのとき、酸化マグネシウムは何gできていますか?
答えは2.0gです!
マグネシウムが1.2g、酸化マグネシウムが2.0gなので
何gの酸素が化合していますか(・・?
答えは0.8gですね(^^)
では、マグネシウム:酸素:酸化マグネシウムの
質量比を求めてください!(^^)!
分かりましたか?
答えは3:2:5
ですね(^^)/
こちらも先ほどと同じで
化合する質量の比は決まっているので
どこでやっても、どんなときも
マグネシウム:酸素:酸化マグネシウムは3:2:5になります(^^)/
質量の比を使って分かること
先ほど
銅:酸素:酸化銅=4:1:5
マグネシウム:酸素:酸化マグネシウム=3:2:5
ということが分かりました!
ここで、問題です。
銅4gを十分に酸素と化合させると、酸素は何g化合して、
酸化銅は何gできるでしょうか?
先ほどの質量の比
銅:酸素:酸化銅=4:1:5を使いますよ(^^)/
分かりましたか(・・?
正解は酸素1g、酸化銅5gです(^^)/
続いて、少しレベルアップ
マグネシウムを十分に化合させて、酸化マグネシウム1.0gつくるためには
マグネシウムは何g必要で、酸素は何g必要でしょうか?
先ほどの
マグネシウム:酸素:酸化マグネシウム=3:2:5
を利用しますよ(^^)/
分かりましたか?
正解は
マグネシウムが0.6gで、酸素が0.4です(^^)/
では、もっとレベルアップします(^^;)
0.5gの銅を加熱し、酸素と化合させる。
0.6gになったところで加熱をやめた。
化合した酸素は何gで、できた酸化銅は何gで、未反応の銅は何gか?
使うのは銅:酸素:酸化銅=4:1:5
ですね(^^)/
どうでしょう(・・?
難易度が高くなりましたが、よく出る問題です(;^_^A
この問題では、まず酸素から考えるのが良いでしょう(^^)
0.5gの銅に酸素が化合し、0.6gになっていますので
銅:酸素:酸化銅=4:1:5より
化合した酸素は0.1gです(^^)/
酸素が分かれば、反応した銅と
できた酸化銅の質量がわかります
銅:酸素:酸化銅=4:1:5なので
反応した銅は0.4g
できた酸化銅は0.5gとなりますね(^^)/
最後に未反応の銅について考えます。
実験後の物質は酸化銅と、未反応の銅ですね!
実験後の物質が0.6gで、酸化銅が0.5gなので
銅:酸素:酸化銅=4:1:5より
未反応の銅は0.1gですね(^^)/
このような問題は何問かやってみるのが良いと思います!
KYD!プリントにも何問か載せていますので
ぜひやってみてください!(^^)!
KYD!プリント
質量保存の法則を理解する
塩酸と炭酸水素ナトリウムの実験から、
質量比を求める問題、
質量比から未反応を考える問題まで全て網羅しています\(^o^)/
KYD!(これさえやっときゃー大丈夫!)プリント
ぜひご活用ください!(^^)/
【問題プリント】
KYD⑥ 化学反応前後の質量
【解答】
KYD⑥ 化学反応前後の質量 解答
KYD!(これさえやっときゃー大丈夫!)プリントの使い方については、私のオススメの方法を
KYD!プリントについて&利用規約
に書いていますので、参考にしてください。
良いなと思ってもらえたら、人に紹介したり、ブックマークをして頂けると幸いです!
読んで頂きありがとうございました!(^^)/





コメント